Cytotoxic effect of lutein extracts from marigold flower in human lens epithelial (HLE) cell line
Natthawadee Yoisara, Bunyaporn Phongsombun, Sakaoduan Chitnan and Pussadee Paensuwan*
Department of Optometry, Faculty of Allied Health Sciences,
Naresuan University, Phitsanulok, Thailand
Correspondence to:
Assistant Professor Dr Pussadee Paensuwan,
Department of Optometry, Faculty of Allied Health Sciences,
Naresuan University, 99 Moo 9 Phitsanulok-Nakhonsawan Road,
Tha-pho, Muang, Phitsanulok 65000 Thailand.
Telephone: +66 (0) 95 307 9713 Fax: +66 (0) 55 966 234 Email: pussadeep@nu.ac.th
Conflict of interest: The authors declare that they have no conflicts of interest with the contents of this article.
Abstract
Lutein is a carotenoid found in the lens of the human eyes. Its functions are to protect the eyes by filtering a hazard blue light and to prevent vision loss due to cataract formation. Lutein could not be synthesised in the body and must be taken from the diet, however, lutein is isolated from a marigold flower. Lutein might help to protect or delay the formation of the posterior capsule opacification (PCO). PCO is a complication that might occur after cataract surgery. In this study, the cytotoxic effect of lutein extracts from the marigold flower was investigated against a human lens epithelial (HLE) cell line. The results indicated that the lutein extract at the concentration of 12 µg per ml showed no cytotoxic effect on the HLE. HLE has no change in cell morphology. The percentage of cell inhibition is 17.3. There was no significant difference in cell viability compared to untreated cells at 24 hours. Cells showed a high percentage of cell viability, with about 82%. Therefore, knowing the optimal concentration of the lutein extracts could be used in further study for developing the PCO treatment.
Keywords: cytotoxicity; human lens epithelial cell; lutein; posterior capsule opacification
การศึกษาความเป็นพิษของสารสกัดลูทีนจากดอกดาวเรืองต่อเซลล์เพาะเลี้ยงชนิดเยื่อบุผิวเลนส์แก้วตาของมนุษย์ (เฮชแอลอี)
ณัฐวดี หยอยสระ, บุณยาพร พงค์สมบุญ, สกาวเดือน จิตนันท์ และผุสดี แผ่นสุวรรณ์*
ภาควิชาทัศนมาตรศาสตร์ คณะสหเวชศาสตร์ มหาวิทยาลัยนเรศวร จังหวัดพิษณุโลก ประเทศไทย
การติดต่อผู้นิพนธ์ประสานงาน:
ผู้ช่วยศาสตราจารย์ ดร. ผุสดี แผ่นสุวรรณ์
ภาควิชาทัศนมาตรศาสตร์ คณะสหเวชศาสตร์ มหาวิทยาลัยนเรศวร
เลขที่ 99 หมู่ 9 ถนนพิษณุโลก-นครสวรรค์ ตำบลท่าโพธิ์ อำเภอเมือง จังหวัดพิษณุโลก รหัสไปรษณีย์ 65000 ประเทศไทย
หมายเลขโทรศัพท์มือถือ: +66 (0) 95 307 9713 หมายเลขโทรสาร: +66 (0) 55 966 234 อีเมล์: pussadeep@nu.ac.th
ผลประโยชน์ทับซ้อน: ผู้นิพนธ์ทุกคนแจ้งให้ทราบโดยทั่วกันว่าไม่มีผลประโยชน์ทับซ้อนในเนื้อหาของบทความนี้
บทคัดย่อ
สารลูทีน (Lutein) เป็นสารที่พบได้ในเลนส์แก้วตา มีหน้าที่ช่วยปกป้องดวงตาจากแสงสีฟ้าที่เป็นอันตรายต่อดวงตา ลดภาวะการสูญเสียการมองเห็น สามารถช่วยลดการเกิดต้อกระจกได้ แม้ว่าร่างกายจะไม่สามารถสังเคราะห์สารลูทีนได้เอง ต้องได้จากการรับประทานอาหารเท่านั้น แต่สารลูทีนสามารถสกัดได้จากดอกดาวเรือง สารลูทีนอาจมีฤทธิ์ในการป้องกันหรือชะลอการเกิดภาวะถุงหุ้มเลนส์แก้วตาขุ่นหลังการผ่าตัดต้อกระจก (Posterior Capsule Opacification, PCO) ซึ่งเป็นภาวะแทรกซ้อนที่อาจเกิดขึ้นหลังจากการผ่าตัดรักษาโรคต้อกระจกได้ การทราบฤทธิ์ความเป็นพิษของสารสกัดลูทีนจากดอกดาวเรืองจึงเป็นสิ่งสำคัญ เพื่อให้เกิดความปลอดภัยในการใช้ประโยชน์จากสารสกัดลูทีน จากผลการศึกษาพบว่าเซลล์เพาะเลี้ยงชนิดเยื่อบุผิวเลนส์แก้วตาของมนุษย์ [Human lens epithelial (HLE) cells] ที่ได้รับสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้น 12 ไมโครกรัมต่อมิลลิลิตร เซลล์ไม่มีการเปลี่ยนแปลงลักษณะทางสัณฐานวิทยา สารสกัดลูทีนไม่มีความเป็นพิษต่อเซลล์ โดยมีค่าการยับยั้งการเจริญของเซลล์ร้อยละ 17.3 และเซลล์มีอัตราการรอดชีวิตร้อยละ 82 ซึ่งไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติ เมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัดลูทีน ณ เวลา 24 ชั่วโมง (p > 0.050) การทราบฤทธิ์ความเป็นพิษของสารสกัดลูทีนจากดอกดาวเรืองใน HLE นี้ อาจนำไปสู่การพัฒนาการใช้สารสกัดลูทีนจากดอกดาวเรืองในการป้องกันหรือชะลอการเกิดภาวะถุงหุ้มเลนส์แก้วตาขุ่นหลังจากการผ่าตัดต้อกระจกในเชิงลึกต่อไป
คำสำคัญ: ความเป็นพิษต่อเซลล์; เซลล์เยื่อบุผิวเลนส์แก้วตาของมนุษย์; ภาวะถุงหุ้มเลนส์แก้วตาขุ่นหลังการผ่าตัดต้อกระจก; สารลูทีน
บทนำ
สารลูทีน (Lutein) เป็นสารสกัดจากธรรมชาติ จัดอยู่ในกลุ่มสารที่มีสีเหลืองจำพวกแคโรทีนอยด์ พบมากในไข่แดง ดอกดาวเรือง โกจิเบอร์รี่ และผักที่มีสีเขียวเข้ม เป็นสารแคโรทีนอยด์ที่พบได้ในโครงสร้างต่าง ๆ ของดวงตา ได้แก่ ในชั้นเรตินาโดยเฉพาะบริเวณศูนย์กลางการมองเห็นที่เรียกว่า "จุดเหลืองจอตา (Macular lutea)" และเลนส์แก้วตา เป็นต้น(1) ร่างกายของมนุษย์ไม่สามารถสังเคราะห์ลูทีนได้เอง ต้องได้จากการรับประทานอาหารเท่านั้น สารลูทีนมีฤทธิ์ในการช่วยปกป้องดวงตา โดยการกรองและดูดกลืนแสงสีฟ้าที่เป็นอันตรายต่อดวงตา มีคุณสมบัติเป็นสารต้านอนุมูลอิสระ ช่วยปกป้องเนื้อเยื่อตาจากการถูกทำลายในสภาวะ Oxidative stress ลดภาวะการสูญเสียการมองเห็น และยับยั้งการดำเนินโรคในผู้ป่วยโรคการเสื่อมจากอายุของ Macula (Age-related macular degeneration, AMD) ได้(2) ตลอดจนสามารถช่วยชะลอการเกิดโรคต้อกระจกได้(3) มีรายงานพบว่าปริมาณของแคโรทีนอยด์ในตาจะมีปริมาณลดลงเมื่อมีอายุมากขึ้น ดังนั้นจึงสอดคล้องกับการเกิดโรคตาที่มีสาเหตุจากภาวะความเสื่อมจากอายุที่มากขึ้น เช่น โรค AMD และโรคต้อกระจก เป็นต้น(4)
ภาวะถุงเลนส์แก้วตาขุ่นหลังการผ่าตัดต้อกระจก [Posterior capsule opacification (PCO)] คือ ภาวะแทรกซ้อนที่อาจเกิดขึ้นได้หลังจากการผ่าตัดต้อกระจก พบประมาณร้อยละ 25 หลังจากการผ่าตัดด้วยวิธี Phacoemulsification(5) มีอัตราการพบได้ในผู้ใหญ่ร้อยละ 34.4 และสูงถึงเกือบร้อยละ 100 ในเด็ก(6,7) ภาวะ PCO เกิดจากกระบวนการตอบสนองต่อการสมานแผล (Wound healing response) ของ Lens epithelial cell (LEC) ที่หลงเหลือจากการผ่าตัด มีการเพิ่มจำนวนเซลล์ (Cell proliferation) และมีการเคลื่อนตัวเซลล์ (Cell migration) จากบริเวณถุงหุ้มเลนส์แก้วตาส่วนหน้ามายังบริเวณถุงหุ้มเลนส์แก้วตาส่วนหลัง ทำให้มีการหนาตัวของถุงหุ้มเลนส์แก้วตาส่วนหลังเป็นผลให้เกิดความขุ่นขึ้น ซึ่งหากเกิดในบริเวณแนวแกนกลางสายตา (Visual axis) ก็จะส่งผลกระทบต่อความสามารถในการมองเห็นได้(8,9) ผู้ป่วยจึงจำเป็นต้องกลับมาเข้ารับการรักษาอีกครั้งด้วยวิธีการ Neodymium-doped yttrium aluminum garnet laser (Nd-YAG laser) เป็นการใช้ลำแสงเพื่อไปสลายภาวะ PCO ที่เกิดขึ้น ซึ่งการรักษาด้วยวิธีนี้มีประสิทธิภาพในการรักษาสูงและความเสี่ยงในการรักษาต่ำ(10) อย่างไรก็ตามการรักษาภาวะ PCO ด้วยวิธีนี้ยังคงมีความเสี่ยงในการเกิดผลแทรกซ้อนตามมาได้ เช่น จอประสาทตาหลุดลอก มี Intraocular pitting และความดันลูกตาเพิ่มสูงขึ้น เป็นต้น(11) อีกทั้งมีค่าใช้จ่ายในการรักษาที่สูงและจำเป็นต้องมีจักษุแพทย์ที่มีความเชี่ยวชาญในการใช้เครื่องมือในการรักษา(6,12,13) ทำให้มีข้อจำกัดในการเข้าถึงการรักษาของผู้ป่วย และอาจไม่สามารถทำได้ในบางประเทศกำลังพัฒนา(13,14) ดังนั้นการใช้ยาที่มีส่วนผสมของสารสกัดจากสมุนไพรอาจช่วยลดปัญหาและข้อจำกัดในการรักษาดังกล่าวได้
จากที่กล่าวมาข้างต้นการใช้สารสกัดจากธรรมชาติที่มีฤทธิ์ในการยับยั้งการเพิ่มจำนวนและการเคลื่อนตัวเซลล์ใน Lens epithelial cell ได้ จะเป็นกลไกที่สำคัญในการนำไปสู่การพัฒนายาที่มีประสิทธิภาพในการป้องกันหรือชะลอการเกิดภาวะ PCO ได้ในอนาคต(15) ดังนั้นการทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ของสารสกัดก่อนการนำสารสกัดมาใช้ประโยชน์ในทางการแพทย์จึงมีความสำคัญ เพื่อให้เกิดความปลอดภัยในการใช้สารสกัด ในงานวิจัยนี้คณะผู้วิจัยจึงนำสารสกัดลูทีนจากดอกเรืองมาทดสอบความเป็นพิษต่อเซลล์ (Cell cytotoxicity assay) โดยใช้ Human lens epithelial (HLE) cell line เป็นต้นแบบการศึกษา เพื่อศึกษาหาความเข้มข้นของสารสกัดลูทีนจากดอกเรืองที่ไม่มีความเป็นพิษต่อเซลล์ และใช้เป็นข้อมูลพื้นฐานในการพัฒนาการใช้สารสกัดลูทีนจากดอกเรืองในการยับยั้งการเกิดภาวะ PCO ในเชิงลึกต่อไป
วัสดุและวิธีการ
การเพาะเลี้ยง Human lens epithelium (HLE) cell line:
ทำการเพาะเลี้ยง Human lens epithelium cell line B-3 (HLE B-3) (ATCC® CRL-11421TM) ในอาหารเพาะเลี้ยงเซลล์ คือ Minimum Essential Medium (MEM) (Gibco™, 11095-080) ที่มีส่วนผสมของ Foetal bovine serum (Gibco™, 16000-036) ความเข้มข้นร้อยละ 20 Penicillin/Streptomycin antibiotic reagent (Gibco™, 10378-016) ความเข้มข้นร้อยละ 1 และ L-Glutamine solution (Gibco®, 25030-081) ความเข้มข้นร้อยละ 1 ทำการบ่มเซลล์ในตู้เพาะเลี้ยงเซลล์ที่อุณหภูมิ 37 องศาเซลเซียส และมีก๊าซคาร์บอนไดออกไซด์ความเข้มข้นร้อยละ 5 โดยระหว่างการเพาะเลี้ยงเซลล์นี้จะทำการติดตามการเจริญเติบโตทุกวันและทำการเปลี่ยนอาหารเพาะเลี้ยงเซลล์ใหม่ 3 ครั้งต่อสัปดาห์ หรือเมื่ออาหารเพาะเลี้ยงเซลล์มีการเปลี่ยนสี เมื่อเซลล์มีการเจริญเกาะติดกับพื้นผิวภาชนะเพาะเลี้ยงและเรียงตัวเป็นชั้นเดียว (Monolayer) และมีความหนาแน่นเซลล์ (Cell confluence) ประมาณร้อยละ 80 – 90 ของพื้นที่ผิวภาชนะเลี้ยงเซลล์ ทั้งนี้จะทำการเพิ่มจำนวนเซลล์ (Subculture) ด้วย Trypsin/EDTA (0.25%) (Gibco™, 25200-072)
การเตรียมสารสกัดลูทีนจากดอกดาวเรือง:
ทำการเตรียมสารสกัดลูทีนจากดอกดาวเรืองตั้งต้น (Stock solution) ที่ความเข้มข้น 100 ไมโครกรัมต่อมิลลิลิตร โดยนำผงสารสกัดมาละลายด้วยตัวทำละลาย Dimethyl sulfoxide (DMSO) (Sigma-Aldrich, 472301) จากนั้นนำสารละลายมากรองผ่านตัวกรองขนาดเส้นผ่านศูนย์กลาง 0.22 ไมโครเมตร ทำการเจือจางให้ได้ความเข้มข้นตามที่ต้องการทดสอบ
การทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ (Cell cytotoxicity assay) ของสารสกัดลูทีนจากดอกดาวเรือง:
ทำการทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ของสารสกัดลูทีนจากดอกดาวเรือง ด้วยวิธี Resazulin reduction test โดยใช้ Deep blue cell viability™ kit (Biolegend, 424702) ที่วัดปริมาณเซลล์ที่มีชีวิต (Viable cell) ด้วยการทดสอบอัตราการเกิดกระบวนการเมตาบอลิซึมของเซลล์ โดยเซลล์ที่มีชีวิตจะเกิดกระบวนการ Resazurin reduction ของเอนไซม์ Mitochondrial reductase เกิดเป็นผลิตภัณฑ์ คือ Resorufin แสดงโดยการเปลี่ยนสีจากสีน้ำเงินของ Resazurin เป็นสีชมพูของ Resorufin วิเคราะห์ผลที่ได้ในหน่วยของ Relative fluorescence units (RFU) ด้วยเครื่อง Fluorometer ที่ช่วง Excitation ที่ 530 – 570 นาโนเมตร และช่วง Emission ที่ 590 – 620 นาโนเมตร
ทำการเพาะเลี้ยงเซลล์ HLE ลงในถาดหลุมเพาะเลี้ยงเซลล์แบบ 96 หลุม ที่ความเข้มข้นเซลล์ 5,000 เซลล์ต่อหลุม ปริมาตร 100 ไมโครลิตร บ่มในตู้เพาะเลี้ยงเซลล์ที่อุณหภูมิ 37 องศาเซลเซียส ที่มีก๊าซคาร์บอนไดออกไซด์ความเข้มข้นร้อยละ 5 นาน 18 ชั่วโมง ทำการทดสอบ HLE ด้วยสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้นต่าง ๆ ดังนี้ 24, 12, 6 และ 0 ไมโครกรัมต่อมิลลิลิตร กำหนดเป็น 0 ชั่วโมง จากนั้นนำไปบ่มเพิ่มอีกเป็นระยะเวลา 24 ชั่วโมง ทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ของสารสกัดลูทีนจากดอกดาวเรือง โดยการเติม Deep Blue Cell Viability™ reagent ที่ปริมาตรร้อยละ 10 ของปริมาตรทั้งหมด โดยปฏิบัติตามข้อกำหนดของบริษัทผู้ผลิต ทำการทดสอบซ้ำทั้งหมด 3 ครั้ง (3N) ซึ่งเป็นอิสระต่อกัน คำนวณหาค่าร้อยละของยับยั้งการเจริญของเซลล์ (% Cell inhibition) ตามสูตรคำนวณด้านล่าง

ทำการวิเคราะห์หาช่วงความเข้มข้นของของสารสกัดลูทีนจากดอกดาวเรืองที่ทำให้เกิดความเป็นพิษต่อ HLE น้อยกว่าร้อยละ 30 เมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัดลูทีนจากดอกดาวเรือง โดยอ้างอิงจากข้อกำหนดของ ISO 10993-5 : 1999 Biological evaluation of medical devices Part 5 : Tests for in vitro cytotoxicity ได้กำหนดให้อัตราการรอดชีวิตของเซลล์ทดสอบที่น้อยกว่าร้อยละ 70 ให้ระบุว่าสารทดสอบนั้นมีความเป็นพิษต่อเซลล์
การวิเคราะห์ทางสถิติ:
ทำการวิเคราะห์ผลทางสถิติโดยแสดงข้อมูลในลักษณะค่าเฉลี่ย ± ความคลาดเคลื่อนมาตรฐานของค่าเฉลี่ย [Mean ± Standard error of the mean (SEM)] ด้วยสถิติทดสอบ Student's t-test และกำหนดค่านัยสำคัญทางสถิติที่ค่า p < 0.050
ผลการศึกษา
การศึกษานี้เป็นการศึกษาเชิงการทดลอง (Experimental study) เพื่อศึกษาอัตราการเจริญของเซลล์ Human lens epithelium (HLE) cell line ซึ่งเป็นเซลล์เยื่อบุผิว (Epithelial cell) ที่เรียงตัวเป็นชั้นเดียวใต้ถุงหุ้มเลนส์แก้วตาส่วนหน้า (Anterior lens epithelial cell) และฤทธิ์ความเป็นพิษของสารสกัดลูทีนจากดอกดาวเรืองต่อ HLE
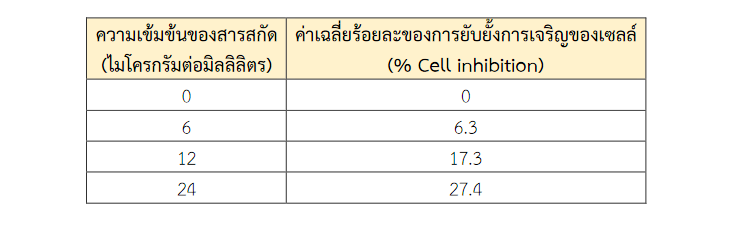
ในการทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ของสารสกัดลูทีนจากดอกดาวเรืองใน HLE ที่ได้รับสารสกัดที่ความเข้มข้นต่างกัน คือ 6, 12 และ 24 ไมโครกรัมต่อมิลลิลิตร ณ เวลา 24 ชั่วโมง พบว่าสารสกัดลูทีนจากดอกดาวเรืองทั้ง 3 ความเข้มข้น มีค่าร้อยละของการยับยั้งการเจริญของเซลล์น้อยกว่าร้อยละ 30 เมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัดลูทีนจากดอกดาวเรือง (0 ไมโครกรัมต่อมิลลิลิตร) คือ ร้อยละ 6.3, 17.3 และ 27.4 ตามลำดับ (ตารางที่ 1) แสดงให้เห็นว่าสารสกัดลูทีนจากดอกดาวเรืองทั้ง 3 ความเข้มข้นไม่มีความเป็นพิษต่อเซลล์ตามข้อกำหนดของ ISO 10993-5 : 1999 Biological evaluation of medical devices Part 5 : Tests for in vitro cytotoxicity หรือเซลล์มีอัตราการรอดชีวิตมากกว่าร้อยละ 70 (รูปที่ 1)
ตารางที่ 1 ค่าเฉลี่ยร้อยละของการยับยั้งการเจริญของเซลล์ (% Cell inhibition) ใน Human lens epithelium (HLE) cell line หลังจากได้รับสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้นแตกต่างกัน ณ เวลา 24 ชั่วโมง
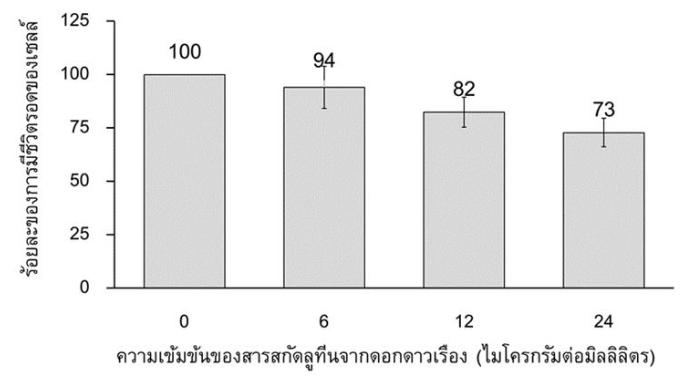
รูปที่ 1 แผนภูมิแท่งแสดงร้อยละการมีชีวิตรอดของ Human lens epithelium (HLE) cell line เมื่อได้รับสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้นแตกต่างกัน ณ เวลา 24 ชั่วโมง
เมื่อทำการศึกษาลักษณะทางสัณฐานวิทยาของ HLE ภายใต้กล้องจุลทรรศน์ พบว่าสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้น 6 และ 12 ไมโครกรัมต่อมิลลิลิตร ไม่ทำให้เซลล์เกิดการเปลี่ยนแปลงรูปร่างและขนาดเซลล์ แต่พบการตายของเซลล์ได้เพิ่มขึ้นที่ความเข้มข้น 24 ไมโครกรัมต่อมิลลิลิตร เมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัด (รูปที่ 2)
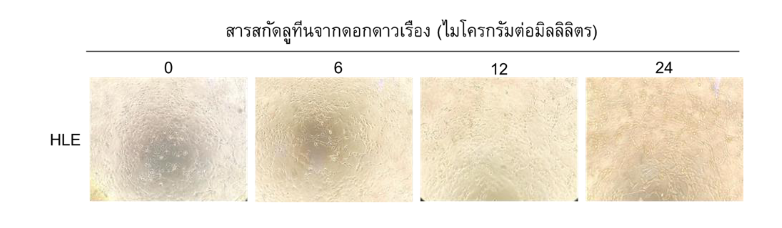
รูปที่ 2 แสดงลักษณะสัณฐานวิทยาของ Human lens epithelium (HLE) cell line เมื่อได้รับสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้นแตกต่างกัน ณ เวลา 24 ชั่วโมง
อย่างไรก็ตามในการศึกษาวิจัยนี้ต้องการศึกษาหาค่าความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ไม่มีความเป็นพิษต่อเซลล์ และเซลล์มีอัตราการรอดชีวิตไม่แตกต่างอย่างมีนัยสำคัญทางสถิติกับ HLE ที่ไม่ได้รับสารสกัด จากผลการทดลองพบว่าสารสกัดที่ความเข้มข้น 24 ไมโครกรัมต่อมิลลิลิตร เซลล์มีอัตราการรอดชีวิตที่ลดลงอย่างมีนัยสำคัญทางสถิติ (p < 0.010) เมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัด ดังนั้นความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ไม่มีความเป็นพิษต่อ HLE และเซลล์มีอัตราการรอดชีวิตที่สูง โดยไม่แตกต่างอย่างมีนัยสำคัญทางสถิติเมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัด คือ 12 ไมโครกรัมต่อมิลลิลิตร (p > 0.050) (รูปที่ 3)
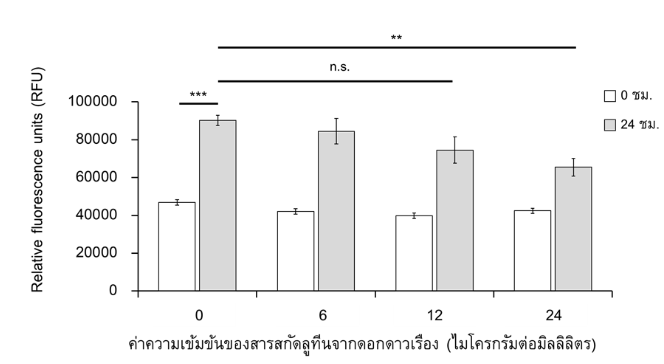
รูปที่ 3 แผนภูมิแท่งแสดงการมีชีวิตรอดของ Human lens epithelium (HLE) cell line เมื่อได้รับสารสกัดลูทีนจากดอกดาวเรืองที่ความเข้มข้นแตกต่างกัน ณ เวลา 24 ชั่วโมง [n.s. = ไม่มีนัยสำคัญทางสถิติ (No statistical significance)]
การอภิปราย
ภาวะถุงเลนส์แก้วตาขุ่นหลังผ่าตัดต้อกระจก (Posterior capsule opacification, PCO) เกิดจากการที่ Lens epithelial cell (LEC) ซึ่งหลงเหลือจากการผ่าตัดต้อกระจกมีการตอบสนองต่อกระบวนการสมานแผล โดยการเพิ่มจำนวนเซลล์และการเคลื่อนตัวเซลล์จากบริเวณส่วนของถุงหุ้มเลนส์แก้วตาส่วนหน้ามายังบริเวณถุงหุ้มเลนส์แก้วตาส่วนหลัง ซึ่งส่งผลกระทบต่อความสามารถในการมองเห็นได้(16) จากรายงานวิจัยก่อนหน้า ได้มีการศึกษาถึงการลดความเสี่ยงในการเกิดภาวะ PCO โดยมุ่งเน้นไปที่การยับยั้งหรือชะลอการเพิ่มจำนวนและการเคลื่อนตัวเซลล์ของ LEC(17,18) อย่างไรก็ตามยังไม่พบว่ามีรายงานฉบับใดที่สามารถแก้ไขหรือป้องกันการเกิดภาวะ PCO ได้อย่างแท้จริง ดังนั้นการศึกษากลไกกระบวนการเกิดภาวะ PCO จึงเป็นสิ่งจำเป็น เพื่อเพิ่มทางเลือกในการป้องกันหรือชะลอการเกิดภาวะ PCO หลังจากการผ่าตัดอย่างมีประสิทธิภาพ ในปัจจุบัน การนำสารสกัดจากธรรมชาติมาใช้ประโยชน์ในทางการแพทย์ได้มีความนิยมมากขึ้น มีรายงานพบว่าสารลูทีน (lutein) สามารถยับยั้งกระบวนการการเพิ่มจำนวนและการเคลื่อนตัวของเซลล์ได้(19) อย่างไรก็ตามการทดสอบฤทธิ์ความเป็นพิษต่อเซลล์ของสารสกัดก่อนการนำสารสกัดมาใช้ประโยชน์ในทางการแพทย์ เป็นสิ่งที่จำเป็นต้องทำก่อนการนำสารสกัดมาใช้เพื่อให้เกิดความปลอดภัยในการใช้สารสกัด ดังนั้นในงานวิจัยนี้จึงได้นำสารสกัดลูทีนจากดอกดาวเรืองมาศึกษาฤทธิ์ความเป็นพิษต่อเซลล์ LEC ของมนุษย์ โดยใช้ Human lens epithelial cell (HLE) เป็นต้นแบบในการศึกษา
จากการศึกษาพบว่าความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ 12 ไมโครกรัมต่อมิลลิลิตร ทำให้ HLE มีอัตราการรอดชีวิตของเซลล์ร้อยละ 82 โดยไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติกับ HLE ที่ไม่ได้รับสารสกัด และมีค่าร้อยละการยับยั้งการเจริญของเซลล์คือ ร้อยละ 17.3 ซึ่งแสดงให้เห็นว่าค่าความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ 12 ไมโครกรัมต่อมิลลิลิตรนี้ไม่ทำให้เกิดความเป็นพิษต่อ HLE ซึ่งเป็นไปตามข้อกำหนดของ ISO 10993-5 : 1999 Biological evaluation of medical devices Part 5 : Tests for in vitro cytotoxicity ที่กำหนดให้เซลล์มีอัตราการรอดชีวิตมากกว่าร้อยละ 70 จึงจะแสดงได้ว่าสารนั้นไม่มีความเป็นพิษต่อเซลล์ แม้ว่าสารสกัดลูทีนจากดอกดาวเรืองที่ 24 ไมโครกรัมต่อมิลลิลิตรทำให้ HLE มีอัตราการรอดชีวิตของเซลล์ร้อยละ 73 แต่พบว่าอัตราการรอดชีวิตของ HLE นี้มีค่าลดลงอย่างมีนัยสำคัญทางสถิติเมื่อเปรียบเทียบกับ HLE ที่ไม่ได้รับสารสกัด คณะผู้วิจัยต้องการหาความเข้มข้นของสารสกัดที่สามารถยับยั้งการเจริญเติบโตของเซลล์ได้โดยไม่ทำให้เกิดการตายของเซลล์ ดังนั้นค่าความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ 12 ไมโครกรัมต่อมิลลิลิตรจึงเหมาะสมในการนำไปใช้เพื่อศึกษาในลำดับต่อไป
การศึกษาหาความเข้มข้นของสารสกัดที่สามารถยับยั้งการเจริญเติบโตของเซลล์ได้โดยไม่ทำให้เกิดการตายของเซลล์ จะสอดคล้องกับฤทธิ์ของยาไมโตมัยซินซี (Mitomycin C) ที่มีรายงานการใช้เป็นยาเสริมในการผ่าตัดต้อกระจก พบว่ามีการขุ่นตัวของถุงหุ้มเลนส์แก้วตาส่วนหลังเกิดขึ้นหลังจากการผ่าตัดลดลงอย่างมีนัยสำคัญทางสถิติเมื่อเปรียบเทียบกับกลุ่มควบคุมที่ไม่ได้รับยา(20) แสดงให้เห็นว่ายา Mitomycin C มีประโยชน์ในการป้องกันและชะลอการเกิดภาวะ PCO สามารถยับยั้งการเพิ่มจำนวนของ LEC ได้ โดยการทำให้เซลล์เกิดการหยุดการแบ่งเซลล์ที่ระยะ G2/M เท่านั้น แต่ไม่ทำให้เกิดการตายเซลล์(21) อย่างไรก็ตามการใช้ยา Mitomycin C อาจเกิดผลข้างเคียงที่อาจเป็นอันตรายต่อดวงตาได้ ดังนั้นคณะผู้วิจัยจึงเล็งเห็นว่าสารลูทีนนั้นเป็นสารที่สามารถสกัดได้จากธรรมชาติ อีกทั้งยังสามารถพบได้ในโครงสร้างต่าง ๆ ของดวงตามนุษย์ น่าจะมีฤทธิ์ในการยับยั้งการเพิ่มจำนวนเซลล์ด้วยการทำให้เซลล์อยู่ในระยะพักของการแบ่งเซลล์ได้ ดังนั้นการทราบความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ทำให้เซลล์มีอัตราการรอดชีวิตที่สูงและไม่มีความเป็นพิษต่อเซลล์ จะสามารถนำไปใช้เป็นข้อมูลพื้นฐานในการศึกษาเชิงลึกเพื่อใช้ในการป้องกันหรือชะลอการเกิดภาวะ PCO ต่อไปได้
อย่างไรก็ตามการทดสอบความเป็นพิษของสารสกัดลูทีนจากดอกดาวเรืองตามที่ได้รายงานในงานวิจัยฉบับนี้เป็นผลการทดสอบในเบื้องต้น โดยทำการวิเคราะห์อัตราการรอดชีวิตของเซลล์เยื่อบุผิวเลนส์แก้วตาของมนุษย์ หลังจากการเพาะเลี้ยงเซลล์ดังกล่าวในสภาวะที่มีสารสกัดเป็นเวลา 24 ชั่วโมงและทำการทดสอบเพียง 3 ความเข้มข้น ดังนั้นเพื่อให้สามารถเห็นผลการทดลองที่ชัดเจนมากยิ่งขึ้น จึงควรทดสอบเซลล์กับสารสกัดที่มีความเข้มข้นแตกต่างกันมากกว่า 3 ความเข้มข้น โดยใช้ผลการทดสอบในงานวิจัยนี้เป็นค่ากำหนดช่วงความเข้มข้นที่ต้องการศึกษาเพิ่มเติม และทำการวิเคราะห์เพิ่มเติม ณ ระยะเวลา 48 ชั่วโมง
สรุป
ค่าความเข้มข้นของสารสกัดลูทีนจากดอกดาวเรืองที่ 12 ไมโครกรัมต่อมิลลิลิตร ทำให้ HLE มีอัตราการรอดชีวิตของเซลล์ร้อยละ 82 โดยไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติกับ HLE ที่ไม่ได้รับสารสกัด และมีค่าร้อยละการยับยั้งการเจริญของเซลล์ คือ ร้อยละ 17.3 ซึ่งแสดงให้เห็นว่าค่าความเข้มข้นนี้ไม่ทำให้เกิดความเป็นพิษต่อ HLE
กิตติกรรมประกาศ
งานวิจัยนี้ได้รับการสนับสนุนงบประมาณการวิจัยจากทุนอุดหนุนการวิจัยเลขที่สัญญา R2560C035 งบประมาณรายได้มหาวิทยาลัยนเรศวร
เอกสารอ้างอิง
- Bone RA, Landrum JT, Friedes LM, Gomez CM, Kilburn MD, Menendez E, et al. Distribution of lutein and zeaxanthin stereoisomers in the human retina. Experimental eye research. 1997;64(2):211-8.
- Semba RD, Dagnelie G. Are lutein and zeaxanthin conditionally essential nutrients for eye health? Medical hypotheses. 2003;61(4):465-72.
- Chew EY, SanGiovanni JP, Ferris FL, Wong WT, Agron E, Clemons TE, et al. Lutein/zeaxanthin for the treatment of age-related cataract: AREDS2 randomized trial report no. 4. JAMA ophthalmology. 2013;131(7):843-50.
- Bernstein PS, Zhao DY, Wintch SW, Ermakov IV, McClane RW, Gellermann W. Resonance Raman measurement of macular carotenoids in normal subjects and in age-related macular degeneration patients. Ophthalmology. 2002;109(10):1780-7.
- Yadav UC, Ighani-Hosseinabad F, van Kuijk FJ, Srivastava SK, Ramana KV. Prevention of posterior capsular opacification through aldose reductase inhibition. Investigative ophthalmology & visual science. 2009;50(2):752-9.
- Vasavada AR, Praveen MR. Posterior Capsule Opacification After Phacoemulsification: Annual Review. Asia-Pacific journal of ophthalmology (Philadelphia, Pa). 2014;3(4):235-40.
- Raj SM, Vasavada AR, Kaid JS, Vasavada VA, Vasavada VA. Post-operative capsular opacification. Nepalese journal of ophthalmology: a biannual peer-reviewed academic journal of the Nepal Ophthalmic Society: NEPJOPH. 2009;1(1):43-59.
- Eric Dai MEB. Opthalmology. 3rd edition ed. China: Elsevier; 2009. 381-409 p.
- Nibourg LM, Gelens E, Kuijer R, Hooymans JM, van Kooten TG, Koopmans SA. Prevention of posterior capsular opacification. Experimental eye research. 2015;136:100-15.
- Khambhiphant B, Liumsirijarern C, Saehout P. The effect of Nd:YAG laser treatment of posterior capsule opacification on anterior chamber depth and refraction in pseudophakic eyes. Clinical Ophthalmology (Auckland, NZ). 2015;9:557-61.
- Karahan E, Er D, Kaynak S. An Overview of Nd:YAG Laser Capsulotomy. Medical Hypothesis, Discovery and Innovation in Ophthalmology. 2014;3(2):45-50.
- Hu Y, Xu Z. Effects of lutein on the growth and migration of bovine lens epithelial cells in vitro. J Huazhong Univ Sci Technolog Med Sci. 2008;28(3):360-3.
- Awasthi N, Guo S, Wagner BJ. Posterior capsular opacification: a problem reduced but not yet eradicated. Archives of ophthalmology (Chicago, Ill: 1960). 2009;127(4):555-62.
- Spalton DJ. Posterior capsular opacification after cataract surgery. Eye (London, England). 1999;13 (Pt 3b):489-92.
- Hu Y-h, Huang X-r, Qi M-x, Hou B-y. Curcumin inhibits proliferation of human lens epithelial cells: a proteomic analysis. Journal of Zhejiang University Science B. 2012;13(5):402-7.
- Awasthi N, Guo S, Wagner BJ. Posterior Capsular Opacification: A Problem Reduced but Not Yet Eradicated. JAMA Ophthalmology. 2009;127(4):555-62.
- Cortina P, Gómez-Lechón MJ, Navea A, Menezo JL, Terencio MC, Diaz-Llopis M. Diclofenac sodium and cyclosporin A inhibit human lens epithelial cell proliferation in culture. Graefe's Archive for Clinical and Experimental Ophthalmology. 1997;235(3):180-5.
- Rieck PW, Kriegsch J, Jaeckel C, Hartmann C. [Effect of suramin on proliferation and migration of lens epithelial cells in vitro]. Ophthalmologe. 2004;101(1):73-9.
- Hu Y, Xu Z. Effects of lutein on the growth and migration of bovine lens epithelial cells in vitro. Journal of Huazhong University of Science and Technology [Medical Sciences]. 2008;28(3):360.
- Shin DH, Kim YY, Ren J, Weatherwax AL, Pearlman RB, Kim C, et al. Decrease of capsular opacification with adjunctive mitomycin C in combined glaucoma and cataract surgery. Ophthalmology. 1998;105(7):1222-6.
- Kang SG, Chung H, Yoo YD, Lee JG, Choi YI, Yu YS. Mechanism of growth inhibitory effect of Mitomycin-C on cultured human retinal pigment epithelial cells: Apoptosis and cell cycle arrest. Current Eye Research. 2001;22(3):174-81.


